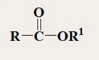Derivate Asam Karboksilat Derivate asam karboksilat adalah turunan dari asam karboksilat, hal ini dilihat dari perubahan struktur dari pergantian gugus –OH dalam struktur RCOOH oleh gugus NH2, -OR atau –OOCR. Terdapatnya gugus karbonil did alam turunan asam karboksilat membuat turunannya bersifat polar, kepolaran turunan ini berpengaruh terhadap sifat yang ada pada turunan tersebut. Turunan asam karboksilat memiliki gugus fungsi asil (-RCO) dan gugus fungsi aril (-ArCO). Nah, apabila turunan tersebut dihidrolisis akan menghasilkan produk berupa asam karboksilat. Kereaktifan Derivat Asam Karboksilat Suatu turunan asam karboksilat apabila dijalankan reaksi hidrolisis akan menghasilkan produk asam karboksilat, hal ini dipengaruhi olehnya karena mengandung gugus pergi yang tinggal, gugus elektronegatif yang bisa hilang dan dapat hilang sebagai anion (X- atau RCO2-) atau ini bisa berperan sebagai anion yang terprotonasi (ROH dan R2NH). Salah satu factor kereaktifan turun...